国家药监局综合司关于印发医疗器械临床试验检查要点及判定原则的通知
药监综械注〔2018〕45号
2018年11月28日 发布
各省、自治区、直辖市食品药品监督管理局(药品监督管理局),核查中心:
为加强医疗器械临床试验过程的监督管理,指导监管部门开展医疗器械临床试验监督检查工作,根据《医疗器械注册管理办法》和《医疗器械临床试验质量管理规范》要求,国家药品监督管理局组织制定了《医疗器械临床试验检查要点及判定原则》,现予以发布。
国家药监局综合司
2018年11月19日
医疗器械临床试验检查要点及判定原则
根据《医疗器械注册管理办法》和《医疗器械临床试验质量管理规范》等要求制定本检查要点及判定原则,用于指导医疗器械临床试验现场检查工作。
一、检查要点
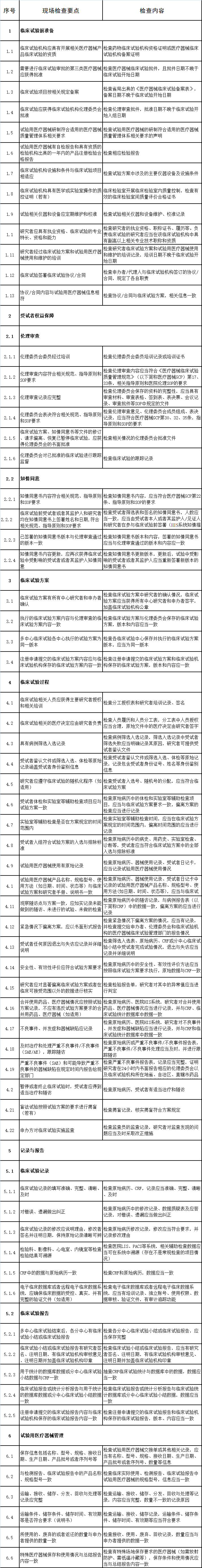
二、判定原则
根据检查发现的问题,检查结果按以下原则判定:
(一)有以下情形之一的,判定为存在真实性问题:
1.编造受试者信息、主要试验过程记录、研究数据、检测数据等临床试验数据,影响医疗器械安全性、有效性评价结果的;
2.临床试验数据,如入选排除标准、主要疗效指标、重要的安全性指标等不能溯源的;
3.试验用医疗器械不真实,如以对照用医疗器械替代试验用医疗器械、以试验用医疗器械替代对照用医疗器械,以及以其他方式使用虚假试验用医疗器械的;
4.瞒报与临床试验用医疗器械相关的严重不良事件和可能导致严重不良事件的医疗器械缺陷、使用方案禁用的合并用药或医疗器械的;
5.注册申请的临床试验报告中数据与临床试验机构保存的临床试验报告中的数据不一致,影响医疗器械安全性、有效性评价结果的;
6.注册申请的临床试验统计分析报告中数据与临床试验统计数据库中数据或分中心临床试验小结中数据不一致,影响医疗器械安全性、有效性评价结果的;
7.其他故意破坏医疗器械临床试验数据真实性的情形。
(二)未发现真实性问题的,但临床试验过程不符合医疗器械临床试验相关规定要求的,判定为存在合规性问题。
(三)未发现上述问题的,判定为符合要求。






