近日,我院内分泌科孙春萍博士作为共同第一作者(排名第二)在国际顶级期刊《自然·化学生物学》(Nature Chemical Biology)(中科院一区Top,IF = 14.8)上发表题为《人类脂质磷酸磷酸酶催化机制的结构基础研究》的重要研究论文。本研究首次使用高分辨率冷冻电镜结构,并结合体外功能实验,详细阐明了LPP1酶催化底物的机制。该研究解析了人源脂质磷酸酶1(LPP1)在关键催化中间态下的高分辨率冷冻电镜结构,并结合体外功能实验,详细阐明了LPP1催化底物LPA去磷酸化的机制。其底物LPA和S1P信号在胚胎血管生成、免疫炎症反应、神经系统发育以及肿瘤发生发展过程中均发挥核心作用,因此其信号强度和持续时间必须受到严格调控,该研究为这些疾病的研究提供理论基础。
人体内存在三个LPP家族蛋白——LPP1、LPP2和LPP3,它们与多种代谢疾病(T2DM 、非酒精性脂肪肝、动脉粥样硬化、心血管疾病、多囊卵巢综合征)的发生发展密切相关。研究团队解析了LPP1的高分辨率冷冻电镜结构,发现LPP1以四聚体形式存在,每个单体的保守结构元件——C1、C2、C3基序——形成了位于胞外的催化活性中心。该结构的催化活性中心中未检测到额外的电镜密度,表明该结构处于基态(LPP1-R)(图1A)。研究团队解析了LPP1与磷酸经典类似物钒酸的复合体结构(LPP1-V),成功展示了催化过程中磷酸与C3基序保守组氨酸形成磷酸-组氨酸中间体的构象(图1A)。综合LPP1-R、LPP1-C2M、LPP1-C3M、LPP1-V等结构信息,研究团队提出了LPP1催化LPA等底物分子去磷酸化的催化模型(图1B)。
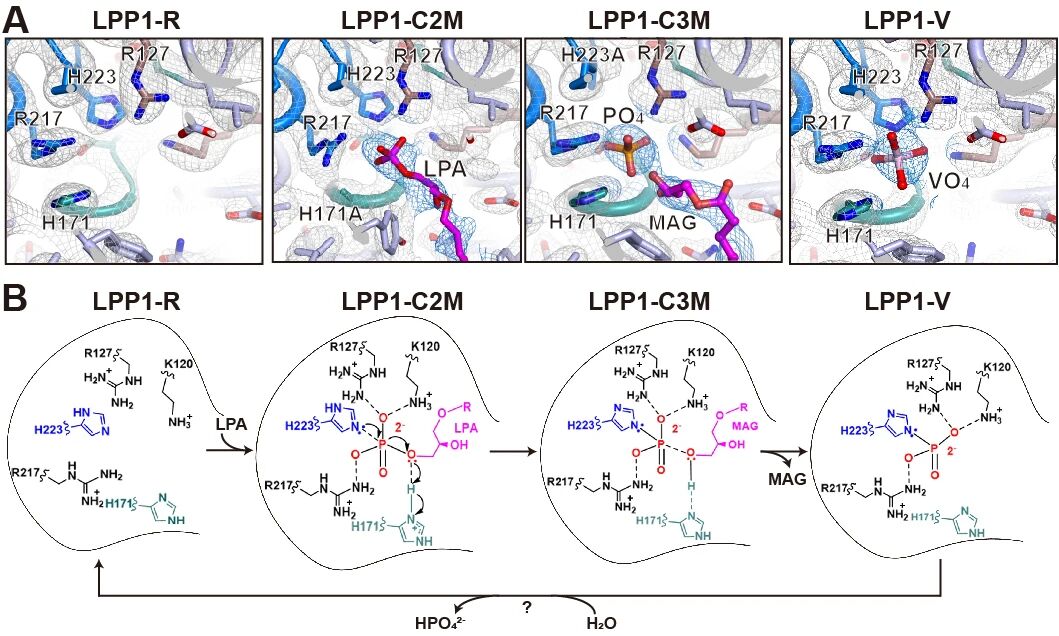
图1 不同中间态LPP1结构及LPP1介导LPA去磷酸化的催化机制
此外,研究团队在LPP1的胞内侧发现了稳定结合的磷脂酰肌醇-4,5-二磷酸(PIP2)分子(图2)。功能实验显示,削弱PIP2结合能力会降低LPP1的催化活性,尤其对S1P水解活性影响最大。考虑到PIP2分子是S1P信号通路下游的关键分子,PIP2对LPP1催化活性的调节作用可能在细胞调制S1P信号的过程中发挥着重要作用。
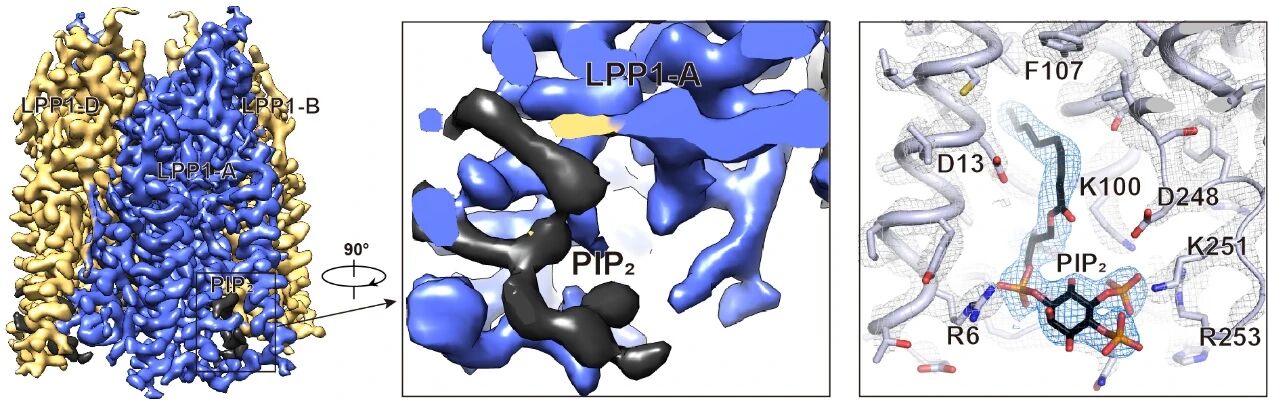
图2. LPP1结构中PIP2电子密度
本研究由中国科学技术大学生命科学与医学部博士研究生杨濛与我院内分泌科孙春萍副教授为共同第一作者,中国科学技术大学钱洪武教授为通讯作者。孙春萍博士在本研究中负责实验设计、数据分析和论文撰写等关键工作。合作单位包括中国科学技术大学生命科学与医学部。研究获得国家自然科学基金、中央高校基本科研业务费、中国科学技术大学安徽省生物医学与健康实验室“人才基金项目”、安徽省卫生健康科研项目、安徽医科大学附属医院青年科技人才培养计划项目等支持。自2024年以来,我院内分泌科与中国科学技术大学生命科学与医学部已建立长期合作关系,在科研与实验方面开展多方位探索。未来,双方将继续深化合作,共同推动代谢性疾病机制研究与临床转化,期待取得更多突破性进展。






