会议审查的标准操作规程
一、目的
为使伦理委员会的会议审查的程序、决定、类别和依据等工作有章可循,提高伦理委员会的会议审查、紧急会议审查工作的效率。
二、范围
适用于采用会议审查或紧急会议审查方式的临床试验项目。
三、内容
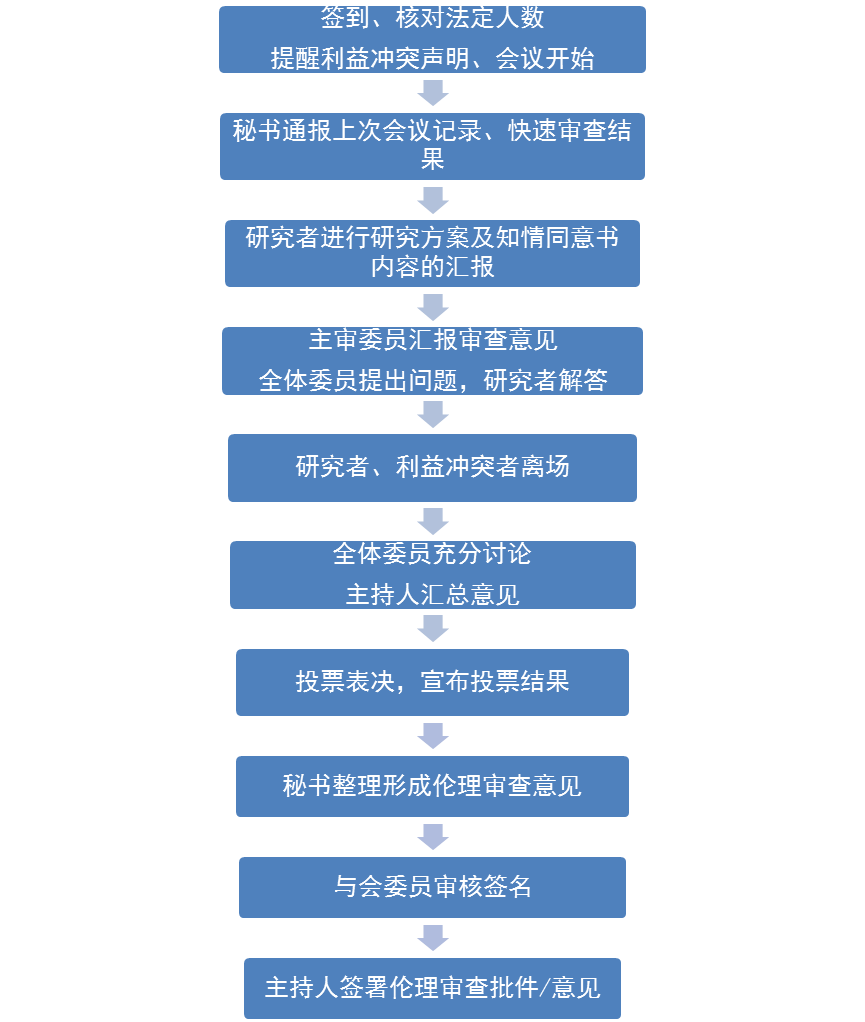
1. 所有参会委员到会并签到。
2. 秘书核对到会人数,确定到会委员的人数、专业及性别均衡性符合法规要求。
3. 主持人提醒与会的委员是否存在利益冲突需要回避。
4. 秘书通报上次会议记录、快速审查结果(包括跟踪审查、偏离方案的审查、终止/暂停研究审查),如有委员提出修改意见,由会议讨论决定。
5. 研究者根据会议审查项目顺序进行研究方案及知情同意书内容的汇报(以PPT的形式)。
6. 主审委员通报审查意见及提问。
7. 其他委员依次提出各自审查意见及提问,研究者及申办者回答委员提出的问题。
8. 研究者、申办者及利益冲突者离开会场。
9. 委员们对项目进行充分讨论(先讨论方案,后讨论知情同意书),主持人对讨论的问题及意见进行归纳和小结,尽量达成共识。
10. 主持人发起投票倡议,参会委员填写审查意见并进行记名投票,以超过全体委员1/2以上票数的意见作为审查决定。投票审查意见有以下四种:
1)同意
对于满足人体受试者研究批准标准的研究项目试验项目,可以做出“同意”的决定,并依据试验项目的风险程度确定项目持续跟踪审查的频率。同意的试验项目必须至少满足以下基本标准:
a)对受试者的风险已经最小化;
b)受试者的风险相对于预期受益来说是合理的;
c)受试者的选择是公平的;
d)知情同意充分,并有相应的文件证明,其中要确保知情同意书、提供给受试者的其他书面资料说明了给受试者补偿的信息,包括补偿方式、数额和计划;
e)必要时,研究有充分的数据和安全监查计划,以保证受试者的安全;
f)必要时,有充分的规定保护受试者的隐私,保证数据的机密性;
g)对弱势群体受试者有相应的保护措施;
h) 方案和知情同意书中要有受试者在临床试验过程中得到基本医疗保障条款。
2)作必要的修正后同意
a)伦理委员会审查认为需对研究方案及其附属文件做出较小修改或澄清的试验项目,可以做出“作必要的修正后同意”的决定。
b)修正方案需再次提交伦理委员会办公室,经伦理委员会秘书和主审委员确认,主任委员签署审查意见书,无需重返下一次伦理委员会会议进行审查,“审查意见书”中应当有修改的内容。
3) 不同意
研究本身是不符合伦理相关要求的,伦理委员会认为即使通过修改方案或补充资料信息也无法满足人体受试者研究的必须标准,可以做出“不同意”决定,“审查意见书”要有否定理由的内容。
4)终止或暂停已同意的研究
a)对于研究过程中出现重大问题,如本中心或其他中心发生死亡且不能排除与医疗器械相关性;
b)试验项目不再满足或难以确定是否继续满足人体受试者研究同意标准,可以做出“终止或暂停已同意的研究”决定;
c)涉及受试者或其他人风险的非预期重大问题;
d)情节严重或持续的违反研究方案。
11. 秘书收集投票单,工作人员记票并汇总审查意见后递交主持人。
12. 主持人通报会议报告投票结果,对投票结果作小结:
1) 建议在可能的情况下,以一致同意的方式做出决定;
2) 若不可能一致同意,同意票应超过全部委员人数的半数;
3) 对于同意的试验项目,确定跟踪审查的频率;
4) 伦理委员会对研究方案、知情同意书和/招募材料的修改建议记录在会议记录中,并形成“伦理审查意见”。
13. 与会委员无异议后继续下一项目的审查。
14. 秘书详细记录会议过程中的讨论内容和所作审查意见,与会委员签名,后主持人签名后形成伦理审查意见文件,其文件交一份给项目申请人。
会议记录包括(但不限于)以下内容:
1)一般信息:会议时间、地点;参会人员、法定人数、利益冲突声明;审查项目、申办者名称;主要研究者、主审委员、整理会议记录者、主任/副主任委员签名。
2)常规内容:主要研究者报告;伦理委员会提问与答疑;伦理委员会讨论;投票决定;伦理委员会审查意见决定。
3)初次审查:
审查内容(不限于)包括:研究方案设计总体是否合理;研究人员是否具备相应的经验和资格;研究风险/受益比是否合理;知情同意告知信息是否充分,受试者招募是否公平合理;是否有相应的保密措施;伦理委员会要求采取的措施。
4)跟踪审查:伦理委员会应当对正在实施的临床试验定期跟踪审查,审查的频率应当根据受试者的风险程度而定,但至少一年审查一次。
审查内容(不限于)包括:研究进展过程是否顺利;是否出现SAE;是否出现影响研究风险/受益比的事件;是否有受试者退出研究;研究的总体风险受益比是否发生变化;伦理委员会要求采取的措施。
5)修正方案审查:修正方案的理由是否充分;修正内容是否合理;伦理委员会要求采取的措施。
6)研究者对临床试验安全性事件报告是否符合以下要求:
除试验方案或者其他文件(如研究者手册)中规定不需立即报告的严重不良事件外,研究者应当立即向申办者书面报告所有严重不良事件,随后应当及时提供详尽、书面的随访报告。试验方案中规定的、对安全性评价重要的不良事件和实验室异常值,应当按照试验方案的要求和时限向申办者报告。
7)提前终止研究报告审查:提前终止研究的决定或建议方;提前终止研究的理由是否合适;伦理委员会要求采取的措施。
15. 会议审查伦理委员会可以聘请独立顾问。独立顾问对所审查项目的特定问题提供咨询意见,但不参与表决。
16. 会议按议程安排进行,主持人可根据情况作相应调整。
17. 伦理委员会应当保留伦理审查的全部记录,包括伦理审查的书面记录、委员信息、递交的文件、会议记录和相关往来记录等。所有记录应当至少保存至临床试验结束后10年。研究者、申办者或者市场监督管理相关部门可以要求伦理委员会提供其标准操作规程和伦理审查委员名单。
四、参考资料
1.《赫尔辛基宣言》,世界医学会联合大会,2013
2.《医疗器械监督管理条例》,中华人民共和国国务院令,2021
3.《涉及人的生物医学研究伦理审查办法》,国家卫生和计划生育委员会,2016
4.《医疗器械临床试验质量管理规范》,国家食品药品监督管理总局 国家卫生和计划生育委员会,2016
5.《体外诊断试剂临床试验技术指导原则》,国家食品药品监督管理总局,2014
五、工作表格
1. 会议签到表(IEC-AF/13)
2. 伦理审查投票单(IEC-AF/14)
六、流程图