临床试验资料受理与处理的标准操作规程
一、目的
伦理委员会办公室对在本中心进行临床试验送审材料的形式审查、发送补充修改或受理通知。使送审文件管理的工作符合相关规范,提高试验项目受理与处理效率。
二、范围
伦理委员会在临床试验资料受理及处理工作中的各环节。
三、内容
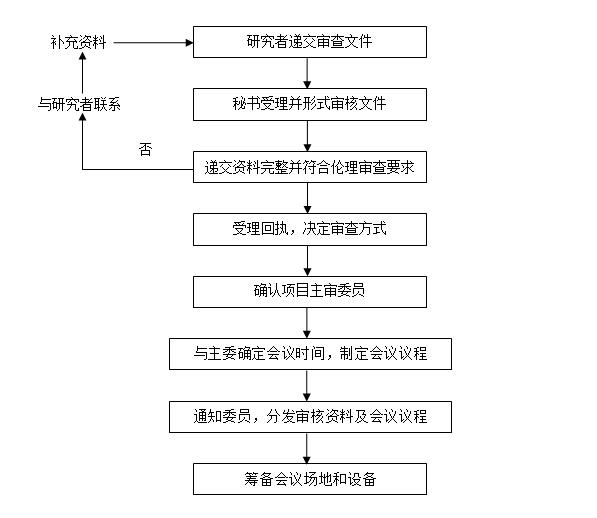
1. 伦理委员会秘书提供相应的伦理审核申请表给研究者,包括:初次审查申请表,修正案审查申请表,复审审查申请表,研究进展报告,违背方案报告,终止/暂停研究报告及结题报告。
2. 研究者准备相关文件与申请表递交给伦理委员会秘书。
3. 研究者根据送审文件清单列出所有递交文件的名称并注明版本号或日期。
4. 秘书受理送审文件,形式审查送审文件:
申请表填写完整,主要研究者签名。
递交资料的完整性。如文件有缺失,通知申请人补齐相关项目。
5. 形式审查无误,给予受理号。受理号形式为:20XX-XXX-XXX(前面的四个数字为公元年份,后面三位数为项目初审受理项目编号,XXX部分为第几次递交文件受理)。举例:2016-001-002表示研究项目为伦理委员会于2016年受理的第1个项目的第2次递交文件受理。
6. 伦理秘书根据制定的SOP决定项目审查方式:
会议审查的标准
a) 首次提交伦理审查的临床试验项目;
b) 伦理审查意见为“作必要的修正后同意”,申请人没有按伦理审查意见进行修改,并对此进行了说明,主审委员认为重新进行会议审查,按“初次临床试验项目”处理;
c) 已经开展项目的修正案审查,快审结果为提交会议审查的项目;
d) 本中心发生的涉及死亡的SAE或严重器械缺陷报告项目;
e) 方案违背/偏离审查,快审结果为提交会议审查的项目;
f) 其它不符合快速审查标准的情况。
紧急会议审查的标准
a) 试验过程中出现非预期的重大或严重问题,危及受试者安全;
b) 试验过程中突发的公共卫生事件,需要对发病人群进行干预,需要对干预措施进行伦理审查。
快速审查的标准
a) 试验风险不大于最小风险,不涉及弱势群体和个人隐私;
b) 按伦理委员会的审议意见修改方案后,再次送审的项目;
c) 临床试验资料的修正案(临床研究资料的涉及行政管理方面的较小修正(例如:增加临床研究中心、研究者、申办者或CRO联系方式变更、其它中心主要研究者变更),不影响试验的风险受益比审查;
d) 临床试验项目的年度/定期跟踪审查;
e) 本中心发生的方案违背/偏离审查;
f) 终止/暂停研究审查;
g) 结题审查。
备案的标准
a) 临床试验物资性质的变更(例如生产厂家的变更),不影响研究的风险受益比。
b) 医疗器械质检报告、研究者手册、受试者保险的变更。
转为会议审查
快审审查意见为“不同意”、“提交会议审查”,则转为会议审查的方式。
7. 伦理秘书将申请表与递交资料保存,将“伦理审查受理回执”交送件人。
8. 伦理秘书建立试验项目文档,记录送审研究项目的名称与受理号。
9. 伦理秘书将试验项目资料按受理的先后次序排放在伦理委员会的文柜中等候处理。
10. 伦理秘书与主任委员确定伦理委员会会议的日期,优先考虑外院委员提供的出席时间,安排会议审查项目。
11. 伦理秘书指定2名主审委员分别对提交的试验方案及知情同意书进行审核,避免选择与试验项目有利益冲突的委员。
12. 伦理秘书准备会议议程,提前一周分发项目文件及主审表给主审委员审查,明确告知主审委员送回审查工作表的最后期限。
13. 秘书预定准备会议室,会议开始前确认会议室室内的设施、设备状况良好,会场整洁。
四、参考资料
1.《赫尔辛基宣言》,世界医学会联合大会,2013
2.《医疗器械监督管理条例》,中华人民共和国国务院令,2021
3.《涉及人的生物医学研究伦理审查办法》,国家卫生和计划生育委员会,2016
4.《医疗器械临床试验质量管理规范》,国家食品药品监督管理总局 国家卫生和计划生育委员会,2016
5.《体外诊断试剂临床试验技术指导原则》,国家食品药品监督管理总局,2014
五、工作表格
1. 初次审查申请表(IEC-AF/03)
2. 修正案审查申请表(IEC-AF/04)
3. 复审审查申请表(IEC-AF/05)
4. 研究进展报告(IEC-AF/06)
5. 方案违背/偏离报告(IEC-AF/07)
6. 终止/暂停研究报告(IEC-AF/08)
7. 结题报告(IEC-AF/09)
8. 伦理审查会议议程(IEC-AF/10)
9. 方案审查工作表(IEC-AF/11)
知情同意书审查工作表(IEC-AF/12)
六、流程图